MDCG发布《标准费用清单》指南:公告机构收费逐步透明
摘要:MDCG发布了今年第二份指南:《MDCG 2023-2标准费用清单》(MDCG 2023-2 List of standard fees),该指南要求公告机构按照相关表格明细提供服务报价,并对较大出入的价格,提供合理解释。

-
与公告机构审核范围相对应的所有活动,以及定期提供的符合性评估活动; -
应说明如何考虑第2003/361/EC号建议中定义的中小型企业的利益; -
如果报价单与最终收费有很大差异,公告机构应通知制造商有关差异,并适当说明理由。

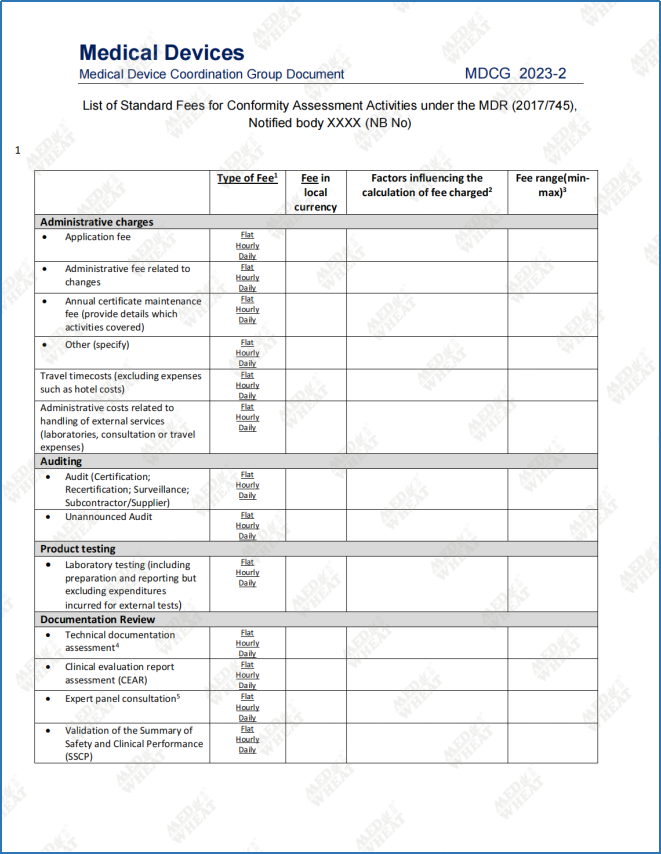
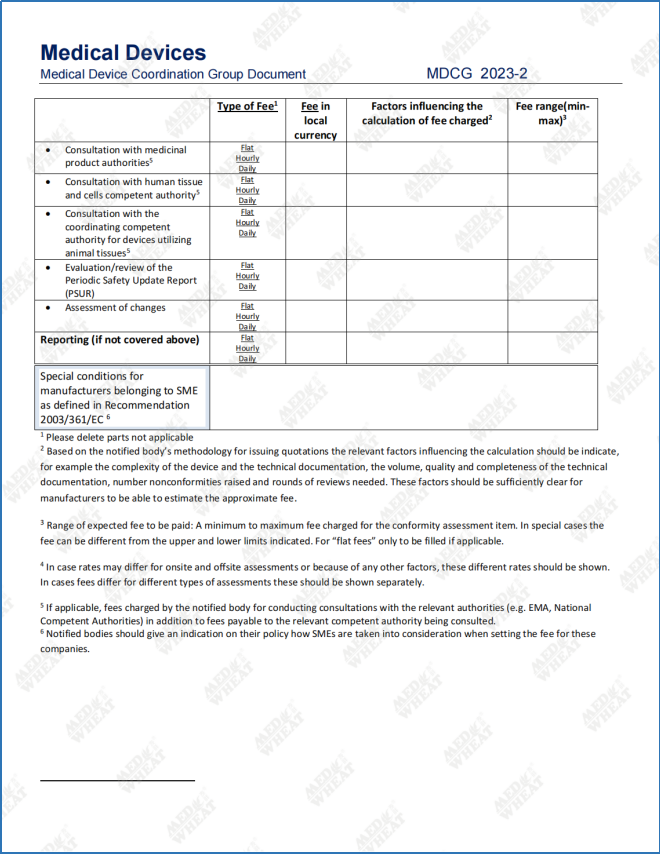
早在MDCG2019-6 section V.2.中,MDCG就已经明确定义了“向公众公开(public availably)”的含义,这意味着本次指南更新后,大家可以直接在公告机构的官方网站上查找到标准费用清单的信息,无需再花额外的精力(比如注册账号提供联系方式),在申请认证的过程中制造商可以更好的了解收费标准。


 澳大利亚
澳大利亚 韩国
韩国 巴西
巴西 日本
日本 俄罗斯
俄罗斯 中国台湾
中国台湾 中国
中国 中国香港
中国香港 欧盟
欧盟 印度尼西亚
印度尼西亚 马来西亚
马来西亚 新加坡
新加坡 菲律宾
菲律宾 美国
美国 加拿大
加拿大 印度
印度 越南
越南 泰国
泰国 沙特阿拉伯
沙特阿拉伯
