欧盟的Basic UDI-DI是欧盟医疗器械法规中的一个概念,是器械类型的主要识别符,该代码与UDI-DI不同。UDI-DI跟着产品走,体现在产品、包装和标签上,实现的是产品追溯目的;而Basic UDI-DI跟着文件走,体现在证书、符合性声明和技术文件中,实现的是文件对应的产品组的识别。Basic UDI-DI的要求已经于2021年5月26日开始生效,广大制造商需要尽快申请编码并纳入自身的MDR文件体系。
Basic UDI-DI是在医疗器械的一个器械组层面上分配DI并完成赋码,这个和原来UDI-DI需要针对每一组别产品中的每个规格,每个包装规格分别赋码是不同的。如下图:5毫升和10毫升的注射器,分别按照100支装箱,那么UDI-D就会有4个DI号码,而此时对应的Basic UDI-DI只有一个统一编码。
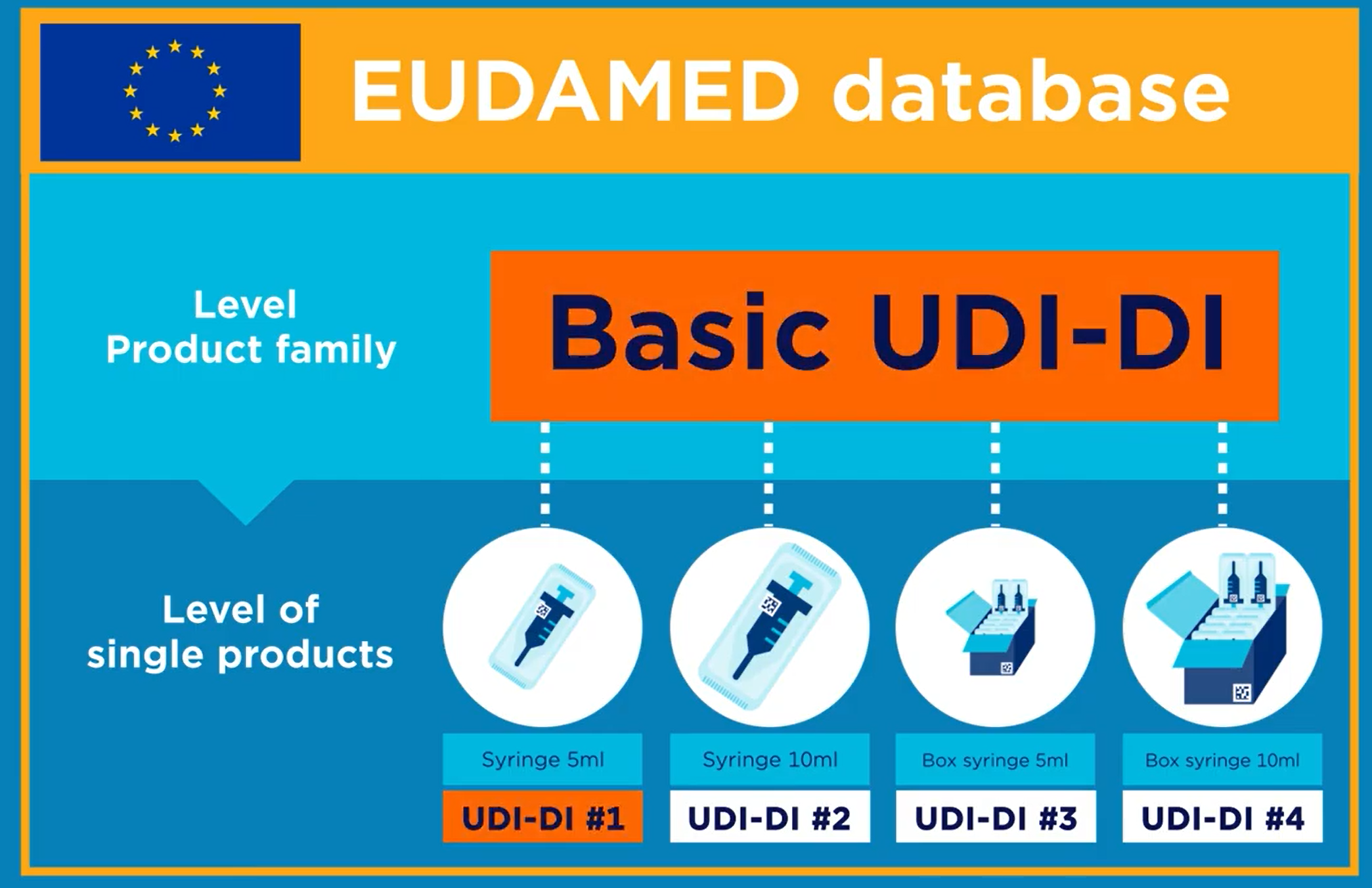
Basic UDI-DI的用处
Basic UDI-DI是EUDAMED数据库中的关键信息,同时会体现在CE证书、欧盟符合性声明和技术文件中。
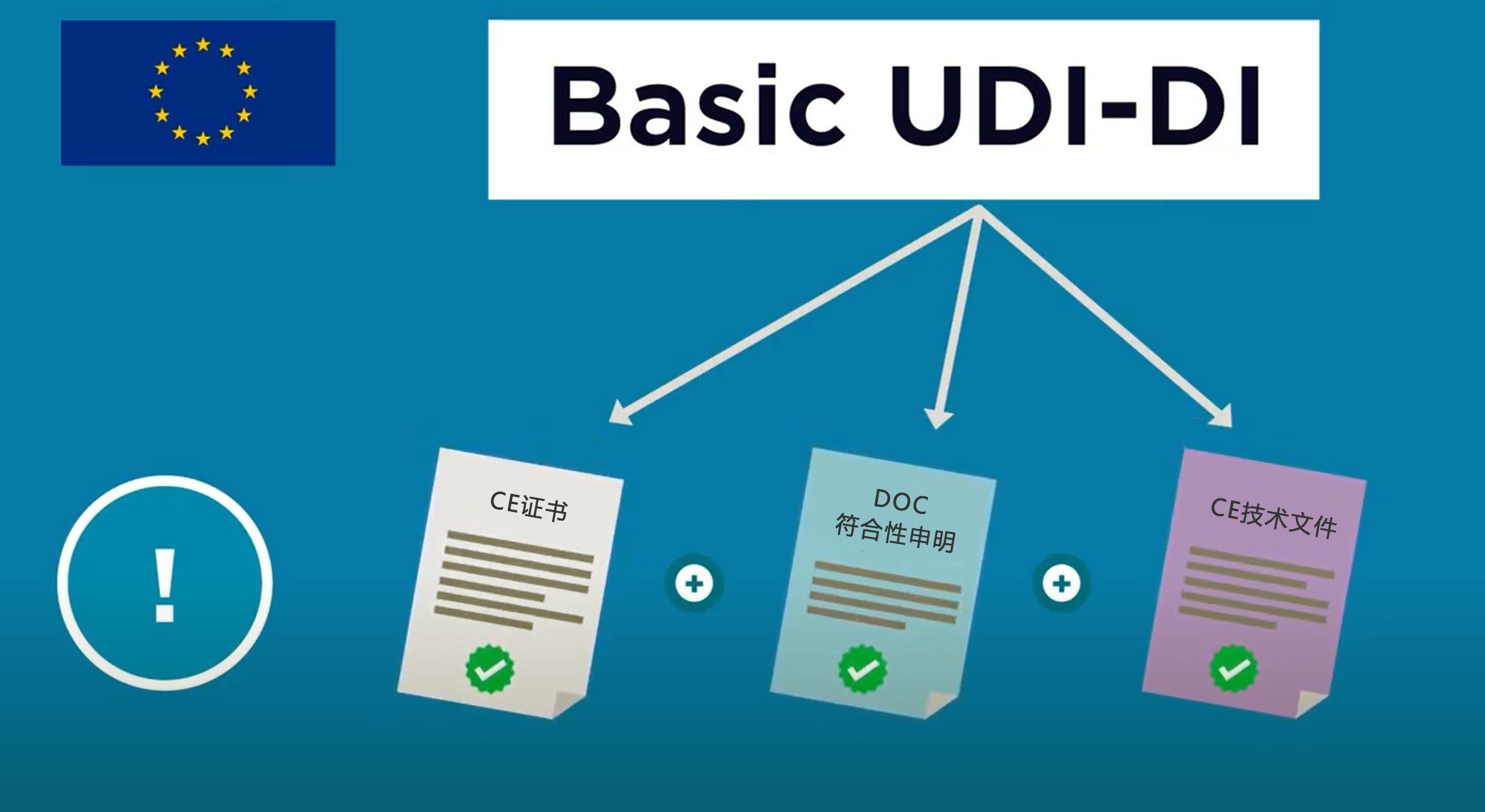
Basic UDI-DI的结构
Basic UDI-DI是由Company Prefix +Model Reference +校验码组成,长度不能超过25位。
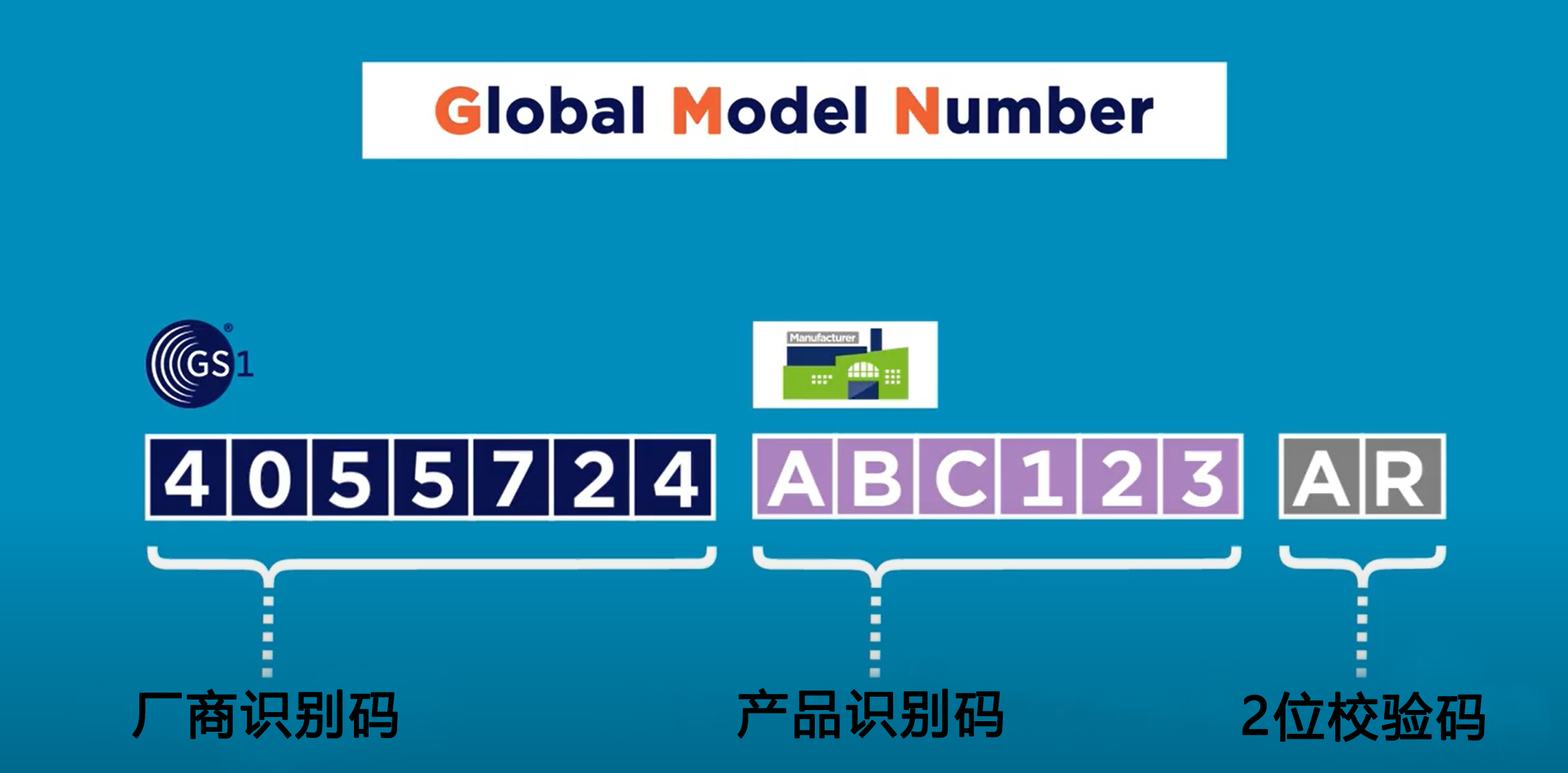
其中,Company Prefix即厂商识别代码,与UDI中的一致。Model Reference,也就是产品识别代码,是由企业自行编制的,可以是字母+数字的形式。
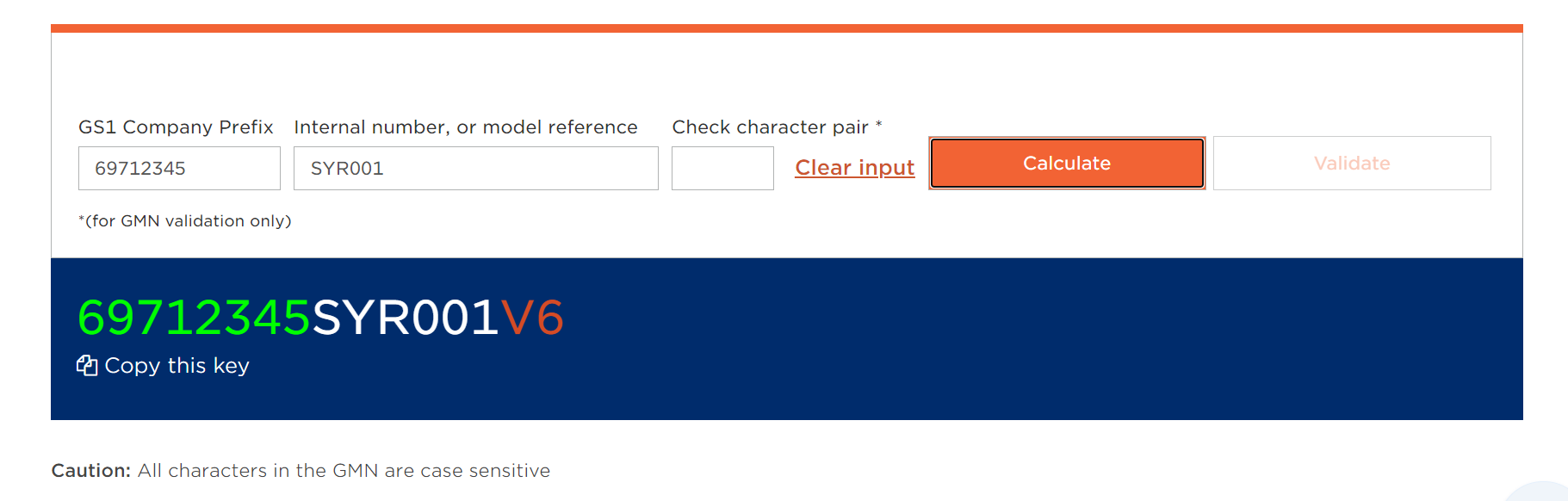
如下图,输入厂商识别码69712345和器械识别码SYR001之后,校验码V6会自动生成。
1) 预期用途;
2) 风险等级;
3) 基本设计和制造特性。
相同的器械,都可以合并申请同一个Basic UDI-DI。

 澳大利亚
澳大利亚 韩国
韩国 巴西
巴西 日本
日本 俄罗斯
俄罗斯 中国台湾
中国台湾 中国
中国 中国香港
中国香港 欧盟
欧盟 印度尼西亚
印度尼西亚 马来西亚
马来西亚 新加坡
新加坡 菲律宾
菲律宾 美国
美国 加拿大
加拿大 印度
印度 越南
越南 泰国
泰国 沙特阿拉伯
沙特阿拉伯