
大家好,我是小编麦洛克。欧盟医疗器械监管法规MDR于2017年5月颁布,标志着《MDD指令》和《AIMDD指令》废止的过渡期开始。而今天,2021年5月27日是MDR 法规正式执行的“第一天”,标志着法规交替过渡期的结束和新一轮监管的开始,Hello MDR!
(EU)2017/745 号《医疗器械法规》MDR使欧盟立法发展的步伐与技术进步、医学变革、以及市场监督实施的完善保持一致;新法规创建了一个国际公认的健全透明及可持续的监管框架,提升了临床安全性,提高了欧盟市场准入的门槛;与老的指令相比,法规可直接适用欧盟各国,不需要转化为成员国的国家法律。因此,新的MDR法规将降低整个欧盟市场可能出现释法、执法不一致的风险。按照新老法规实施交替的安排,老欧洲医疗器械指令(MDD/AIMDD)产品上市认证的证书在今天以前颁发的,有效期到2024年 5月26日止;在2025年5月之前,依据旧指令认证的产品和依据新法规认证的产品可以在市场上共存。但新法规中有关上市后监督、经济运营商责任、器械注册方面的义务将在法规生效之日起适用所有新老认证上市的器械。依据MDD指令投放市场的I类医疗器械,在MDR法规下如果仍归为I类器械的,需要从2021年5月26日起符合MDR法规所有相关要求。UDI的标识/载体要求按照器械分类的执行分阶段实施。其中三类和植入器械实施限期为2021年5月26日;企业对UDI的赋码的要求(如Basic UDI-DI;UDI-DI),用于启动认证申报程序,也是自DoA(Date of Application)之日起。在这个特殊的日子,让我们用些数据来认识一下这个即将与我们“相恋”的MDR。 (一)已获MDR授权的公告机构,共计20家--短小精悍!预计像MDD资质那样的一条长龙将一去不复返!
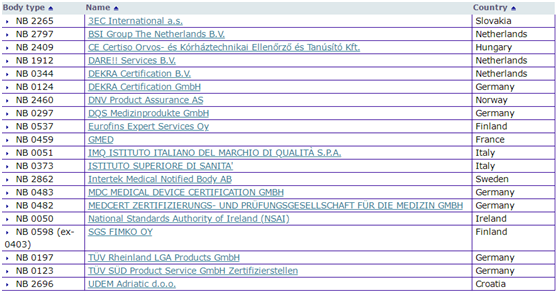
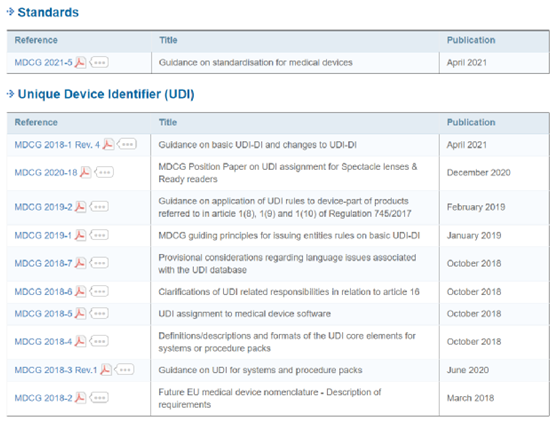
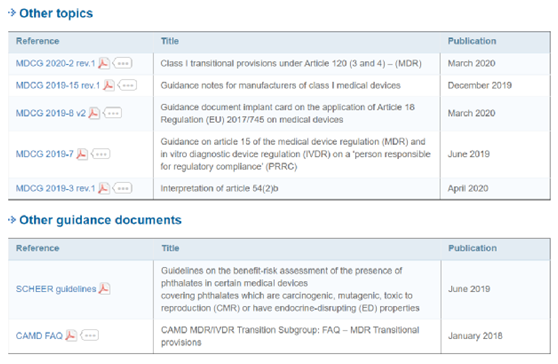
(二)已发布的MDCG指南文件—如涛涛江水,绵绵不绝!
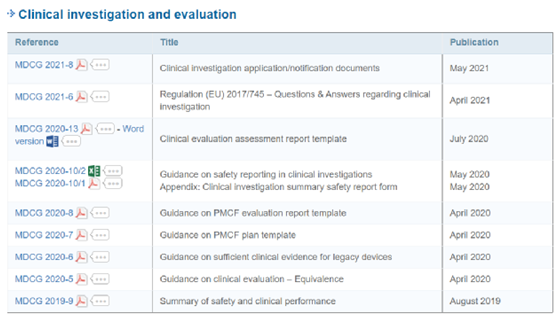
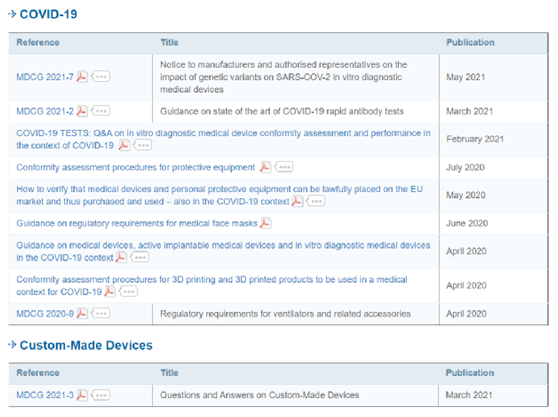
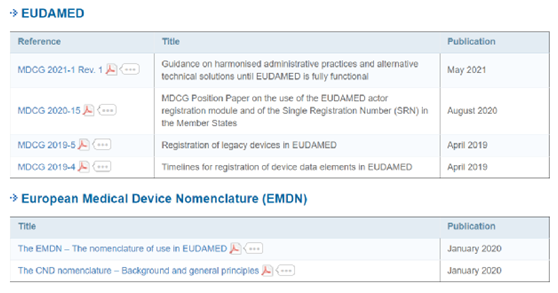

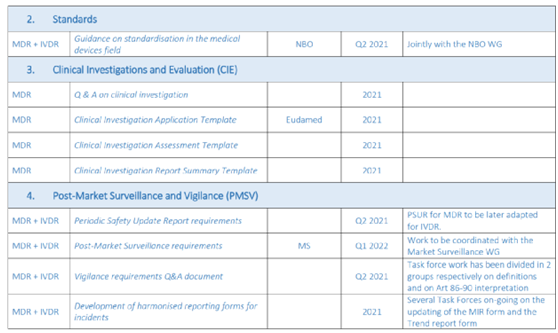
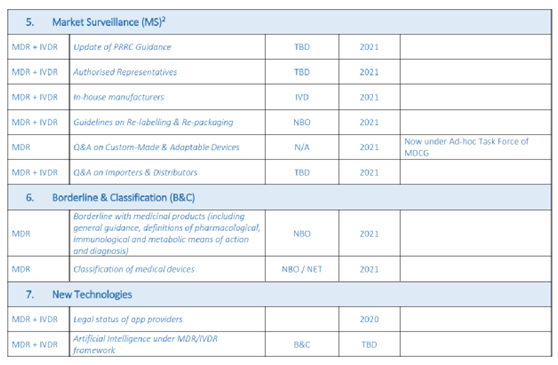
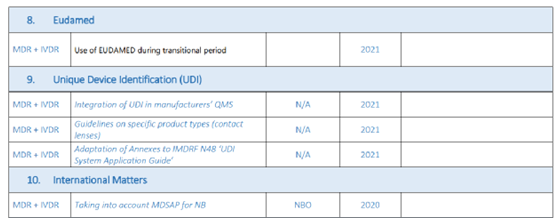
(三)待发布的MDCG指南文件-犹抱琵琶半遮面!












 澳大利亚
澳大利亚 韩国
韩国 巴西
巴西 日本
日本 俄罗斯
俄罗斯 中国台湾
中国台湾 中国
中国 中国香港
中国香港 欧盟
欧盟 印度尼西亚
印度尼西亚 马来西亚
马来西亚 新加坡
新加坡 菲律宾
菲律宾 美国
美国 加拿大
加拿大 印度
印度 越南
越南 泰国
泰国 沙特阿拉伯
沙特阿拉伯