大家好,我是小编麦洛克。
我们今天来谈谈,疫情下美国FDA对COVID-19 IVD(molecularand antigen)病毒传输媒介(Viral Transport Media 简称VTM)的要求。
在检测新冠病毒时,很多获FDA紧急授权使用的体外诊断需要把采集到的临床病毒样本放在传输媒介里,然后送到指定的实验室进行测试。VTM虽然不需要FDA审核批准,但是生产商在VTM(包括PBS-Phosphate-buffered saline)商业化之前需要向FDA备案:产品名称,联系人,进口商/经销商以及使用说明和质量体系文件,并符合以下要求:
(一)VTM产品必须经过灭菌。
(二)VTM生产商需要在商业化前验证产品的有效性,不会破坏样品导致测试的不准确性。验证流程需要符合美国疾控中心(CDC)的标准流程。https://www.cdc.gov/coronavirus/2019-ncov/downloads/Viral-Transport-Medium.pdf
(三)VTM产品需要遵循质量管理体系:21CFR Part 820 或者ISO 13485。疫情下FDA 接受ISO 13485的认证文件。
(四)VTM生产商在完成产品验证后,商业化之前,需要向FDA 备案以下信息:
o 生产商名称,地址;
o 联系人、方式;
o 进口商/经销商;
o 产品名称、使用说明;
o 质量体系证明;
o 验证声明。
o VTM生产商还是需要在FDA系统进行企业列名和产品列名。
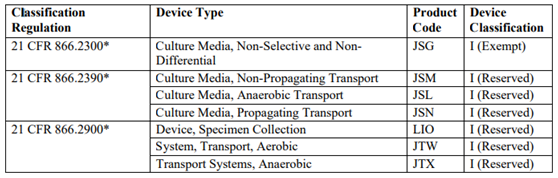
(五)可以用的产品代码有:
(六)产品必须有且不局限于以下标识内容:
o 预期用途;
o 警示以及限制;
o 有效期;
o 所包含的物料清单;
o 性能标准及测试结果;
o 规格;
o 使用说明;
o 生产商姓名及地址。
(七)FDA备案的要求并不适用于生产VTM、但仅自用的实验室。
有任何更新,麦洛克会及时分享,希望对大家有所帮助。

 澳大利亚
澳大利亚 韩国
韩国 巴西
巴西 日本
日本 俄罗斯
俄罗斯 中国台湾
中国台湾 中国
中国 中国香港
中国香港 欧盟
欧盟 印度尼西亚
印度尼西亚 马来西亚
马来西亚 新加坡
新加坡 菲律宾
菲律宾 美国
美国 加拿大
加拿大 印度
印度 越南
越南 泰国
泰国 沙特阿拉伯
沙特阿拉伯