UDI-DI是全称是Unique Device Identifier-DeviceIdentifier,在我们读欧盟新法规MDR和IVDR的时候会不会有这样的困惑:基本的UDI-DI和UDI-DI到底是什么关系?因为这两次概念在法规中多次提到(尤其是前者)但法规似乎又没有把这两者的关系解释的十分清楚,到底两者是包含与被包含的关系还是并列关系抑或是其他关系?小编下面以GS1的UDI编码规则为例,带大家梳理一遍这“剪不断、理还乱”的关系。
1. GS1识别系统
1.1 字符集
GS1识别系统支持三个字符集;特定字符集取决于标识密钥类型。这三个字符集是:
-
数字字符(“0”到“9”);
-
ISO/IEC646表1中的字符-唯一图形字符分配,在本文中称为GS1 AI可编码字符集82(见表1-1);以及
-
数字字符(“0”到“9”)、大写字母字符(“A”到“Z”)和三个特殊字符(“#”、“-”和“/”),在本文中称为GS1 AI可编码字符集39(见表1-2)。
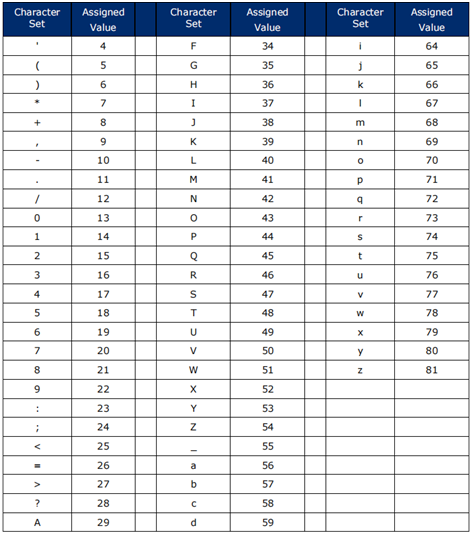
表1-1GS1 AI可编码字符集82
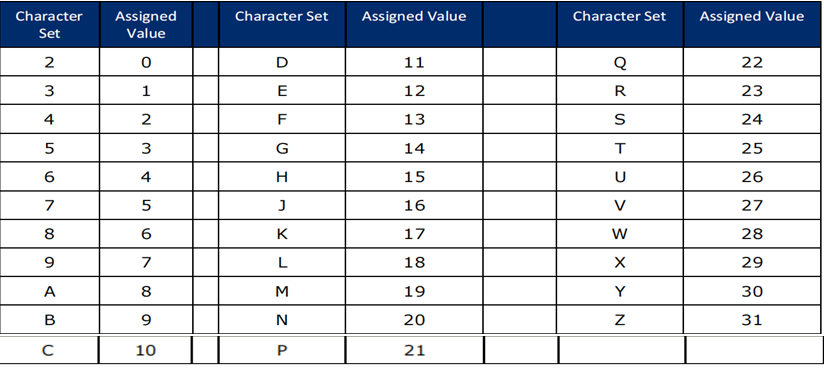
表1-2校验字符参考值
无论标识密钥类型如何,任何标识符中的GS1前缀仅使用数字字符。GS1识别密钥概要见下表1-3。

表1-3GS1识别密钥概要
由于GS1标识系统中的每个标识符都是一个字符串,即使它仅由数字字符组成,所有字符(包括开头的0)都是有效的。
2. 特殊应用
2.1全球型号(GMN)
-
应用说明
GS1全球型号(GMN)是GS1标识码,用于根据行业或法规定义的型号或系列通用属性来标识产品型号或系列。GMN包括GS1公司前缀、模型参考和可选的校验字符对。模型参考使用表1-1 GS1 AI可编码字符集82中的字符,其结构由指定它的品牌所有者决定。此GS1标识密钥一旦分配给一个产品型号或产品系列,则不得重新颁发给另一个。GMN不得用于识别贸易项目。
-
监管医疗器械
对于受监管的医疗器械,GMN是GS1标识密钥,用于支持基本UDI-DI要求的实现;基本UDI-DI是医疗器械UDI监管数据库中的关键元素。通过提供医疗器械产品系列的标识符,GMN将能够将UDI数据库中GTIN确定的医疗器械贸易项目与上市前和上市后活动(如证书、符合性声明、警惕性、市场监督和临床调查)联系起来。
-
以下几点强调了基本UDI-DI(GMN)和UDI-DI(GTIN)之间的关系。
-
基本UDI -DI (GMN)用于医疗器械注册,其分配独立于包装/标签,不同于供应链中的贸易项目标识符(UDI-DI/GTIN)。
-
所有基本UDI-DI(GMN)级别属性(在UDI监管数据库中)对于与其相关的所有GTIN都是通用的。
-
与一个基本UDI-DI(GMN)相关联的所有UDI-DI(GTIN)的所有属性可能不常见。
-
基本UDI-DI用于注册数据库中的设备注册。UDI-DI(GTIN)用于UDI数据库中的贸易项目标识。UDI-DI(GTIN)和基本UDI-DI(GMN)分配可能发生在彼此之前、并行或之后,并且只有当两个实体都存在时,实体之间的归属和/或链接才可能发生。因此,UDI-DI(GTIN)和基本UDI-DI(GMN)的分配应相互独立。
-
品牌所有者负责分配基本UDI-DI(GMN)和UDI-DI(GTIN)。
-
GS1关键要求
-
GMN用于指示全球型号的GS1应用程序标识符是AI(8013)。
-
GMN不得用作GTIN的替代品,反之亦然。
-
对于受监管的医疗器械,以下规定适用:
-
在任何给定时间,基本UDI-DI(GMN)和UDI-DI(GTIN)之间的关系为1:n(可以是一对一或一对多),这意味着基本UDI-DI(GMN)可以与多个UDI-DI(GTIN)相关。
-
基本UDI-DI(GMN)不得用于供应链标识或交易目的(如标签、订单、交付、付款)。供应链中只能使用UDI-DI(GTIN)。
-
UDI-DI(GTIN)不得替代基本UDI-DI(GMN)。
-
在文档中,基本UDI-DI(GMN)应显示为单个数据字段,但标识符的文本表示中可使用粗体或斜体等格式,以提高键输入的效率和准确性。基本UDI-DI(GMN)中不允许空格作为字符。
-
适用于基本UDI-DI(GMN)的附加规则
-
应包括校验字符对。
-
长度不超过25个字符,包括两个校验字符。
3. GS1应用程序标识符定义
3.1按数字顺序排列的GS1应用程序标识符,见表3-1
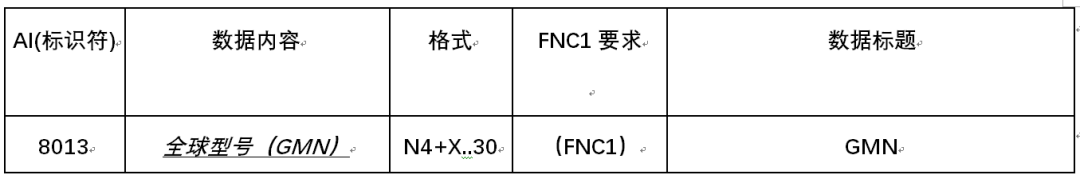
表3-1GS1应用程序标识符
注意:
第一个位置表示GS1应用程序标识符的长度(位数)。下值表示数据内容的格式,适用以下约定:
-
n隐含小数点位置;N数字;
-
X表5-1中的任意字符;N3数字,预定义长度;
-
N..3最多3个数字;X..3表5-1中最多3个字符。
3.2以数字8开头的GS1应用程序标识符
-
全球型号(GMN):AI(8013)
GS1应用标识符(8013)指示GS1应用标识符数据字段包含GMN(全球型号)。GMN用于产品型号或产品系列的唯一标识。GS1前缀由GS1成员组织分配给GMN的品牌所有者。这使得这个数字在世界范围内独一无二。对于受监管医疗器械以外的产品型号或产品系列,GMN可用于相关贸易项目的任何标签、物理标记或GS1 AIDC数据载体。模型参考的结构和内容由品牌所有者决定。它可能包含表1-1中列出的所有字符。校验字符对的验证必须在应用软件中进行,以确保标识符的正确组成。
-
医疗器械监管
对于受监管的医疗器械,GMN不得用于相关贸易项目的任何标签、物理标记或GS1 AIDC数据载体。在文件或证书上标明基本UDI-DI(GMN)时,应使用以下数据标题:GMN。应用标识符(AI)8013应排除在此类文件和证书中。符合欧盟医疗法规的GMN,最大总长度应为25个字符,包括强制校验字符对,见表3-2。

表3-2符合欧盟医疗法规的基本UDI-DI(GMN)格式
4.GMN规则
4.1分配全球型号
全球型号(GMN)可用于识别衍生和/或注册贸易项目的基础产品设计或规格。用于分配GMN的确切方法由品牌所有者自行决定。但是,每个GMN对于每个被识别的产品型号或产品系列必须是唯一的,并且一旦分配给一个产品型号或产品系列,就不能重新发布以识别另一个产品型号或产品系列。
对于受监管的医疗器械:基本UDI-DI(GMN)的分配由品牌所有者自行决定,但应符合监管规则。
4.1.1职责:品牌所有者负责发布和分配全球型号。
4.1.2 与全球型号相关的信息
与产品型号或产品系列相关的数据应记录并共享,使用全球型号作为信息的关键。
对于受监管的医疗器械,以下规定适用:基本的UDI-DI(GMN)属性对于与之相关的所有UDI-DI(GTIN)都是通用的。在UDI监管数据库中,该标识符可归属于与其相关联的UDI-DIs(GTINs)。

 澳大利亚
澳大利亚 韩国
韩国 巴西
巴西 日本
日本 俄罗斯
俄罗斯 中国台湾
中国台湾 中国
中国 中国香港
中国香港 欧盟
欧盟 印度尼西亚
印度尼西亚 马来西亚
马来西亚 新加坡
新加坡 菲律宾
菲律宾 美国
美国 加拿大
加拿大 印度
印度 越南
越南 泰国
泰国 沙特阿拉伯
沙特阿拉伯