大家好,我是小编麦洛克。随着美国新冠疫情的加重,美国FDA对一些个人防护设备批准了紧急使用授权,用以减缓疫情扩散。
-
Umbrella EUA for surgical masks
-
N95 and Other Respirators EUAs
-
Umbrella EUA forNon-NIOSH-Approved Disposable Filtering Facepiece Respirators (FFRs)
-
Umbrella EUA for Imported,Non-NIOSH-Approved Disposable Filtering Facepiece Respirators (FFRs)
-
Face Shields and Other EUAs
对于中国生产的Non-NIOSH-ApprovedFFRs,美国FDA在进一步评估了性能指标后,于2020年5月份和6月份修改并重新颁布了EUAs,FDA批准的FFRs EUA 总结在了一个Appendix A 表格里(见文章末),10月份以后不再接受除了Appendix A 以外的新的FFR的EUA申请。那么没有被批准的Non-NIOSH-Approved FFRs想要进入美国市场还有哪些选择呢?以下是FDA的建议:
-
在COVID-19大流行期间,FDA宣布了一项政策,该政策适用于旨在医疗目的但却提供不了液体屏障保护作用的口罩(请参阅 theEnforcement Policy for Face Masks and Respirators During the CoronavirusDisease (COVID-19) Public Health Emergency (Revised))。FDA还授权使用符合某些标准的面罩,以供公众(包括医疗机构中的医护人员)使用,以作为非外科口罩EUA中所述的源控制(即,不作为个人防护设备(PPE)使用)。
-
如FDA执行政策中所述,对于不符合器械定义的产品,不需要FDA设备行销授权(例如,该产品的标签符合非医用条件且向大众销售)。
-
如果您正在考虑为您的FFR提交单独的EUA请求,请注意,鉴于FDA从该EUA中删除了资格标准,因此FDA不鼓励此类提交,考虑到FDA时间和资源的限制而且美国对这些FFR的市场需求减少,授权该类型的其他FFR几乎是不可能的。
希望以上内容可以对大家有所帮助,下期再会!
Appendix A
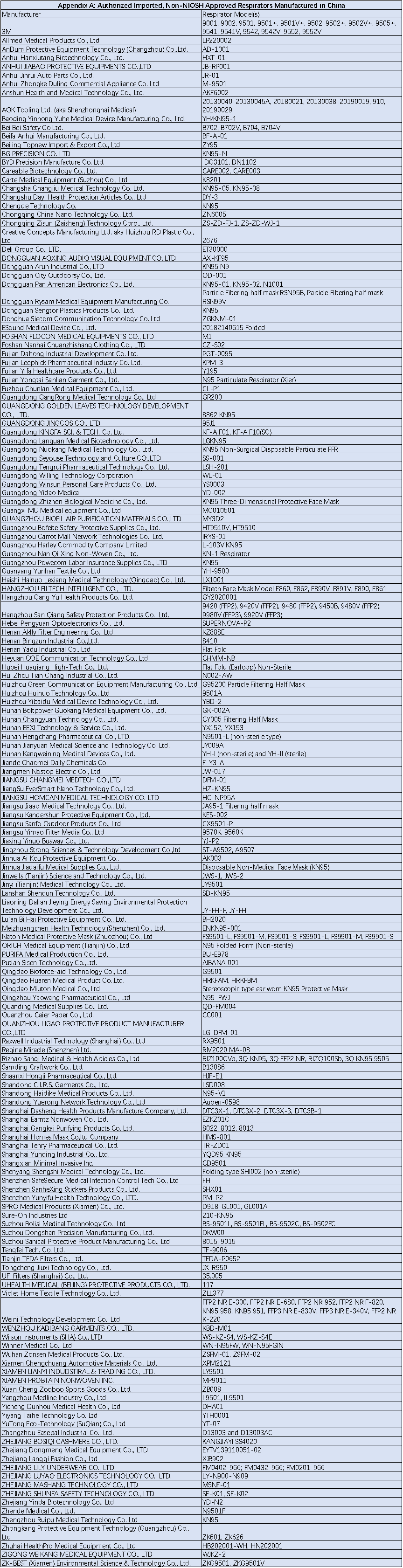

 澳大利亚
澳大利亚 韩国
韩国 巴西
巴西 日本
日本 俄罗斯
俄罗斯 中国台湾
中国台湾 中国
中国 中国香港
中国香港 欧盟
欧盟 印度尼西亚
印度尼西亚 马来西亚
马来西亚 新加坡
新加坡 菲律宾
菲律宾 美国
美国 加拿大
加拿大 印度
印度 越南
越南 泰国
泰国 沙特阿拉伯
沙特阿拉伯