
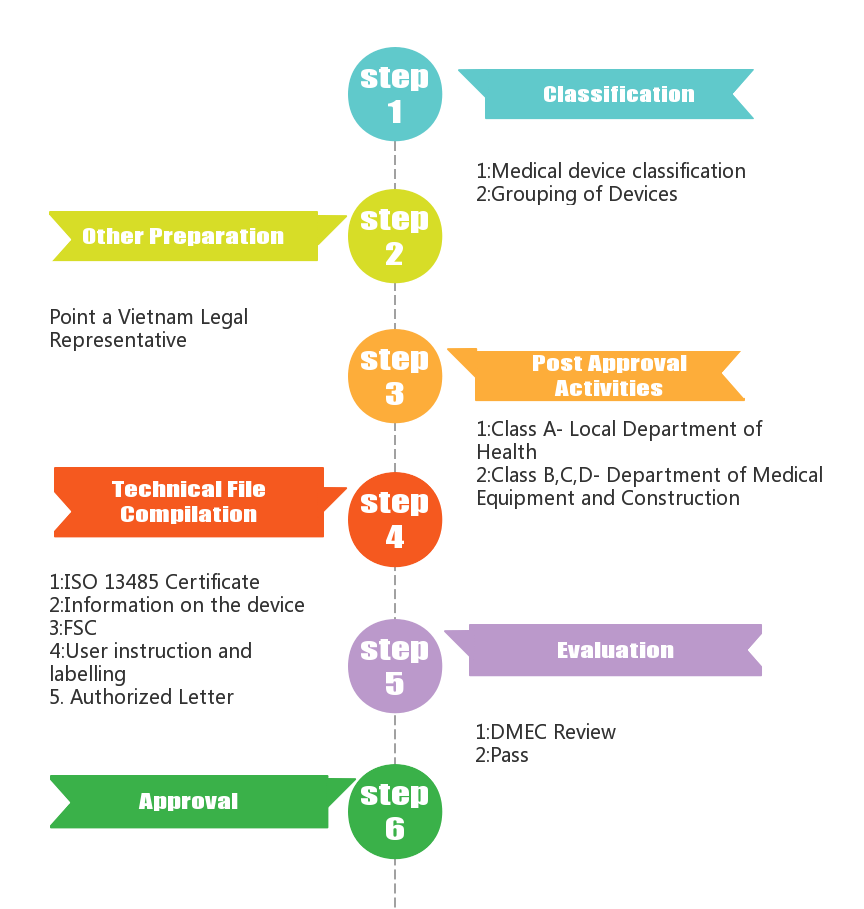
一、认证模式
在医疗器械越南严格遵循 GHTF 的医疗器械分类指南,按风险从低到高分为A类、B类、C类、D类。A 类和 B 类器械受卫生部省级办公室监督的通知程序的约束。C 类和 D 类设备的注册申请则由中央卫生部完成。没有参考国家批准或国家标准的 C 类和 D 类申请将需要进行可能需要长达 90 天的技术审查。具有参考国家批准或相同国家标准的产品将避免技术审查,并应在大约 10 个工作日内获得批准。从 2023 年开始,所有申请都需要通用提交档案模板 (CSDT)。目前申请注册无需技术文件。在 2023 年 1 月 1 日之前,所有类别器械的文件都可以用越南语或英语提交。一些文件(如 IFU 和技术摘要)需要使用越南语。根据新法令,MA 许可证不会过期。
注意事项:
1.质量体系合格评定
所有制造商都需要 ISO 13485,授权代表需要在公司执照中具有法人实体和正确的范围,进口商、分销商需要购买和销售许可证。
2.必要文件要求
ISO 13485、FSC、符合性声明(可以按照CE)、授权书、保修资格书(声明谁负责维修或更换,不适用于一次性使用器械)、技术摘要根据申请表,临床测试(仅适用于 C 类和 D 类侵入性设备,如果有来自 CE、美国、日本、澳大利亚或加拿大 5 个司法管辖区之一的FSC,则可以豁免),越南语使用说明,标签等。
3.参考国家批准的快速审查
卫生部还更新了医疗器械的快速审查程序,参考国家包括美国、加拿大、欧洲、日本或澳大利亚。作为 98/2021 的一部分,卫生部将可接受的参考国家批准扩大到中国的NMPA和韩国的MFDS。至少获得这些市场之一批准的产品仍需要提交所需的文件(技术摘要、标签、IFU、手册,直到 2022 年 12 月 31 日),但可缩短的技术档案评估等待时间,从 60 个工作日缩短为 10 个工作日。
此外,为了帮助已经上市的制造商顺利过渡到 MA 许可证,卫生部还将允许对具有进口许可证的产品免除 C 类和 D 类产品的技术审查。
4.有效期和续订
一旦颁发,MA 许可证就不会过期。所有进口许可证将于 2022 年 12 月 31 日到期。
二、审核流程
注意事项:
许可证持有人要求
医疗器械制造商必须指定并向越南当地注册公司授予授权书,以担任注册持有人并提交注册申请。根据新规定,注册持有人可以授权无限数量的分销商根据 MA许可证进口,以及参与公开招标。但一个产品可以有一个以上的持证人或者转移给其他持证人;另外,产品注册完成后,许可证持有人可以指定经销商进口和批发,不需要许可证持有人的干预;所以制造商无需担心。
相关链接:越南医疗器械(含IVD)注册分类

 澳大利亚
澳大利亚 韩国
韩国 巴西
巴西 日本
日本 俄罗斯
俄罗斯 中国台湾
中国台湾 中国
中国 中国香港
中国香港 欧盟
欧盟 印度尼西亚
印度尼西亚 马来西亚
马来西亚 新加坡
新加坡 菲律宾
菲律宾 美国
美国 加拿大
加拿大 印度
印度 越南
越南 泰国
泰国 沙特阿拉伯
沙特阿拉伯