韩国医疗器械注册|MFDS注册流程时间节点

MFDS注册流程时间节点(节点均为预估)
第一步:准备阶段,确定产品分类(I,II,III,IV),选择韩代KLH1个月,可直接选择 Medwheat Korea 作为韩代。
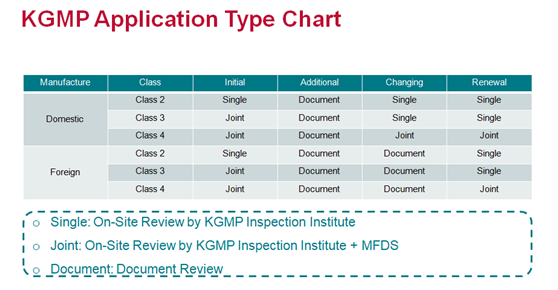
第二步:II/III类产品需申请KGMP证书和接受现场审核,II类产品一般是授权的第三方审核员,并获得KGMP证书3个月。III/IV类器械,可能会由MFDS直接安排人员进行审核。
第三步:送样检测,可以在中国境内的符合韩国GLP要求的实验室进行检测,价格比在韩国内检测便宜。
第四步:由韩代向MFDS提交技术文件(技术文件,检测报告,KGMP证书),进行注册审批1个月。
第五步:支付申请费用,注册文件发补并整改,注册批准3个月左右,通过后持证。


 澳大利亚
澳大利亚 韩国
韩国 巴西
巴西 日本
日本 俄罗斯
俄罗斯 中国台湾
中国台湾 中国
中国 中国香港
中国香港 欧盟
欧盟 印度尼西亚
印度尼西亚 马来西亚
马来西亚 新加坡
新加坡 菲律宾
菲律宾 美国
美国 加拿大
加拿大 印度
印度 越南
越南 泰国
泰国 沙特阿拉伯
沙特阿拉伯