韩国医疗器械注册要求简介(二)

韩国医疗器械规模的年均增长率达10.3%,并且这几年一直保持着稳定的发展趋势。然而,与美国等其他发达国家相比,目前韩国医疗器械产业的国际竞争力仍处于较低水平,其国内半数以上的获准医疗器械都源于韩国境外的国家。对于中国医疗器械企业来说,韩国算是个不错的海外市场。
下面Medwheat就跟大家一起来了解一下在韩国获得医疗器械MFDS注册证的过程要求。
首先,是持证人制度。我们得确定韩国证书持证人KLH(Korea License Holder),即韩代。不在韩国境内的企业需要选择一个韩国证书持证人(通常为在韩国的分销商),协助企业进行产品注册。不过若选择分销商作为持证人会导致后期无法变更分销商,故可选择没有销售合作并有能力协助产品注册的韩国企业。注意:在韩国MFDS注册时,如果你是通过经销商注册的,可以同时多家经销商注册同一个产品,注册过程中告知MFDS产品的一致性,之后所经历的审核问题会是一致的且轻松。这样能大大降低注册时间和费用,且能尽可能增加韩国的器械市场接触面。
其次,确定类别和注册途径。这里不多解释,可以在MFDS的系统里找到类似器械作为参考,或者参考具体法规确认产品的ABCD/1234类别。I类产品一般只需要进行上市前通知,但是技术文件需要完整的准备,线上备案制;II 、III、IV类产品需要进行上市前许可。高风险器械直接由MFDS审核,中低风险由第三方审核。
资料准备:I类较宽松,只需在MFDS网上在线登记,建议按照STED格式来准备文件,其实做过日韩注册的同学,都知道日本韩国对文件要求很类似,当然做过PMDA注册的同学,可能对日本的相谈会更有感触,太细致太贵;II III IV类必须通过韩国医疗器械主管部门全面审核通过后才可进入韩国市场。针对II~IV类产品,技术文件大体包括:ISO13485证书;产品说明书;产品宣传册;原材料检测报告;包装文件;产品有效性文件(货架寿命验证报告);产品性能检测报告;临床评价报告;软件资料;电气安全和电磁兼容检测报告;生物相容性检测报告;等。
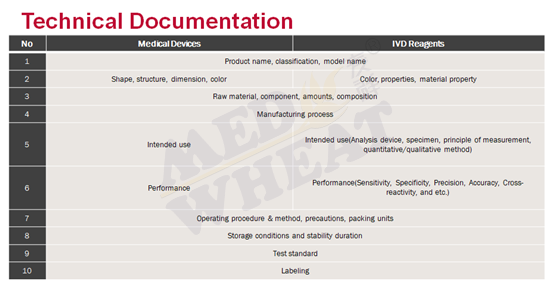
对于检测报告:
I类,可以提交制造商的自我检测报告。其他类别的报告须要有符合规定的实验室资质进行检测。对于产品使用性能检测,一般都可以使用企业自检报告,但是要注意检测过程的可靠性,这点类似日本。
韩国临床试验数据要求:
韩国罗列了一部分器械,必须提供临床(历史)数据。一般我们国内目前的耗材类申请注册的器械,与已在韩国上市的产品实质性等同,不会强求提供临床历史数据。临床历史数据一般包括类似/相同器械的境外临床GCP符合的数据、文献paper(Meta系统评价已经成为趋势,将来同学们在进入MDR阶段后Meta其实是能帮企业避免欧盟临床的非常有价值的路劲之一),PMCF数据、以及其它等。类似于日本PMDA临床评价对数据的要求。
取得注册证书:
审核资料后若有不充分的地方,会提出发补要求。满足后2-3月取得产品注册证书。证书没有有效期。
医院准入:
获得产品注册证及KGMP证书后,需要进行医院准入,进入医院的医保系统,取得医院医保号。此后,就可以正式销售了。(约2个月)

 澳大利亚
澳大利亚 韩国
韩国 巴西
巴西 日本
日本 俄罗斯
俄罗斯 中国台湾
中国台湾 中国
中国 中国香港
中国香港 欧盟
欧盟 印度尼西亚
印度尼西亚 马来西亚
马来西亚 新加坡
新加坡 菲律宾
菲律宾 美国
美国 加拿大
加拿大 印度
印度 越南
越南 泰国
泰国 沙特阿拉伯
沙特阿拉伯