
大家好,我是麦洛克。今天我们讲解的是医疗器械行业AI数据处理体系建立,基于我们目前的项目过程经验和大家做一些分享。
说到人工智能数据处理,相信已经有一部分医疗器械行业的QA/RA/临床的人员接触到了。在举目不远的将来,相信基于人工智能的大数据训练算法器械会越来越多。有一点可以相信,基于大数据的一批辅助诊断器械,某种角度解决了医院医务人员的缺乏,并且诊断结果的可靠性应当不亚于真实人类的能力。算法如果有足够的数据并且没有被锁死的话,甚至随着仪器的临床病例的增加,不断成长进化,相信这也是人智的魅力之一。
目前在医疗器械行业,人工智能器械领域,有具体的要求的,主要是中国NMPA和美国FDA。美国出台了GMLP(Good Machine Learning Practice),中国目前有《深度学习辅助决策医疗器械软件审评要点》。我们的分享会有三个部分:1)先对美国FDA的AI 管理做个简单介绍;2)其次,对中国深度学习审评要点进行适度解析;3)最后是在人工智能数据处理过程中,碰到的一些问题及目前我们的解决方案,如:模型训练评价及算法结果评价等。
本篇为第一部分,我们用FDA的一些要求,为后面的内容做铺垫。
首先,我们说说概念:
Artificial Intelligence has been broadly defined as the science and engineering ofmaking intelligent machines, especially intelligent computer programs.Artificial intelligence can use different techniques, including models based onstatistical analysis of data, expert systems that primarily rely on if-thenstatements, and machine learning. (McCarthy, 2007)
人工智能被广泛定义为制造智能机器的科学和工程,特别是智能计算机程序。人工智能可以使用不同的技术,包括基于数据统计分析的模型、主要依赖if-then语句的专家系统以及机器学习。
(PS: John McCarthy 1927年9月4日生于美国波士顿,计算机科学家与认知科学家。被称为“人工智能之父”。)
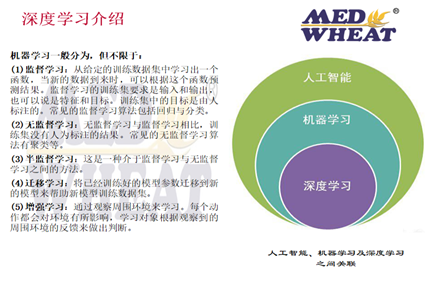
这是目前国际上普遍接受的AI定义,目前美国的法规建制里,引用的就是这个定义。在我们IT领域中,人工智能又可以根据其神经网络的层次深度,分为传统机器学习和深度学习。机器学习的神经网络一般小于等于三层。
FDA的人工智能审核指南讨论稿截至2019年6月3日,目前已生效。与其相关的软件类指南有:
-
Developing Software Precertification Program: A Working Model V1.02019
-
Software as a Medical Device (SaMD): Key Definitions (IMDRF SaMDWorking Group) 2013
-
Software as a Medical Device (SAMD): Clinical Evaluation - Guidancefor Industry and Food and Drug Administration Staff 2018
-
Deciding When to Submit a 510(k) for a Software Change to anExisting Device 2017
-
Modifications to Devices Subject to Premarket Approval (PMA) - ThePMA Supplement Decision-Making Process 2008
-
"Software as a Medical Device": Possible Framework forRisk Categorization and Corresponding Considerations 2014
同学们,如果有兴趣可以找来看看玩玩,主要是留心它的分类和审核要求。

FDA一般把AI器械按照其预期分为两种:
1) Significance of information provided by the SaMD to the healthcaredecision, which identifies the intended use ofthe information provided by the SaMD – i.e., to treat or diagnose; to driveclinical management; or to inform clinical management; and (辅助决策)
2) State of healthcare situation or condition, which identifies the intended user, disease or condition, and thepopulation for the SaMD – i.e., critical; serious; or non-serious healthcaresituations or conditions. (病情识别)
在这两种预期分类的基础上,AI器械可有四个风险级别,见下图:
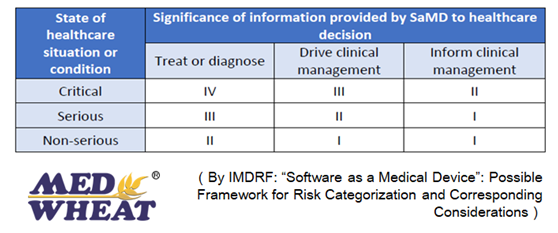
依据病情的严重程度,如果是严重条件下,如:不同部位的肿瘤、致死率很高的病毒感染等,相关的治疗和诊断往往属于Class IV,该类别器械往往需要临床历史数据(可以是科研临床回顾性数据)以及IDE(可以和FDA沟通一个小规模临床)。
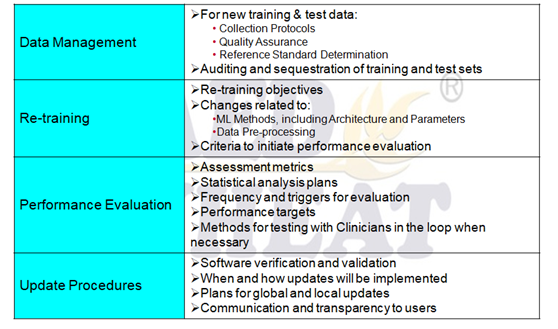
在监管要求中,FDA依据算法的特性,增加了新的法规描述文件要求,即SaMD Pre-Specifications SPS和AlgorithmChange Protocol ACP。对于软件产品,需要递交三部分文档:1)基础的软件描述文档;2)软件网络安全文档;3)基于算法特点的SPS和ACP。FDA认为在AI器械的生命周期中,软件的衍变主要表现在:性能、输入源和预期用途等方面,见下图。

我们以ACP举例,当AI器械算法发生实质变更时(即性能、输入和预期等),需要在新产品的以下方面在ACP中对算法进行变更信息补充,见下表:
如果同学们对本文部分感兴趣,欢迎留言回复,我是麦洛克,今天我们对FDA的AI要求做了简要介绍,后面我们深入讨论我们中国的,大家下期再见!

 澳大利亚
澳大利亚 韩国
韩国 巴西
巴西 日本
日本 俄罗斯
俄罗斯 中国台湾
中国台湾 中国
中国 中国香港
中国香港 欧盟
欧盟 印度尼西亚
印度尼西亚 马来西亚
马来西亚 新加坡
新加坡 菲律宾
菲律宾 美国
美国 加拿大
加拿大 印度
印度 越南
越南 泰国
泰国 沙特阿拉伯
沙特阿拉伯