如何处理日本(PMDA)医疗器械注册中的MAH制度(一)

在中美贸易战和欧盟法规动荡期的时局下,中国医疗器械产业的出口已经产生了瓶颈,并且越发的严重,相信在后面2-5年左右中国的器械出口会是一个被抑制的阶段。中国要走出去,不仅要想办法维持原有的市场,更是要开拓新的需求。
展眼望去,中国周边还是有一些机会的,比如:日本市场。进入日本市场不得不提及日本的MAH制度。日本MAH部分会分成五个章节进行细讲。
日本《药事法》最早始自于明治七年,我们现在延用的法规主体是昭和三十五年八月十日颁布的,即1960年。当时是没有MAH制度的,知道2002年对该法规进行了修改,把原先的制造认可制度,改为了现在的制造销售认可制度。原先的日本市场模式中,仅有GMP这一项许可必要条件,如今转变为GMP、GVP以及GQP三项许可必要条件。老的模式中只考虑制造设备工厂的要求,转变为制造业与制造销售业并存的模式。新模式还产生了委托生产模式,这点和我们中国的委托生产有点类似,只是日本生产就是生产,不能直接销售,必须符合了销售经营许可才可以上市,通过法规对生产和销售进行了隔离。(药事法变化流程图)
(图)日本药事法演变
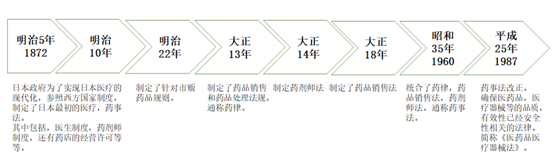
目前药事法是2015年版的,该法规制定了各种各样的规定,以使医药产品的制造销售厂商对制造到上市后的整个过程承担责任。这里要强调制造销售厂商的概念,制造商不仅仅需要登入,并且要与销售商进行承接,每批货物需要检验。
笔者亲自探访多家日本MAH/DMAH实地情况,按照日本的医疗器械的分类情况,MAH/DMAH可以分为三个级别,见下图表:
|
MAH(Marketing Authorization Holder)的类别 |
可处理产品的类别 |
|
I类 医疗器械 MAH |
高度控制医疗器械(III类/IV类) |
|
需控制器械(II类) |
|
|
普通医疗器械(I类) |
|
|
II类 医疗器械 MAH |
需控制器械(II类) |
|
普通医疗器械(I类) |
|
|
III类 医疗器械 MAH |
普通医疗器械(I类) |
同是在日本PMDA的监管条件下,药品的MAH只能是一类产品一张MAH资质,而医疗器械貌似松一些。向下兼容,I类MAH可处理四种类别的医疗器械产品。日本的化妆品MAH是各个类别都划在一个类别的MAH下,无其它MAH分类。


 澳大利亚
澳大利亚 韩国
韩国 巴西
巴西 日本
日本 俄罗斯
俄罗斯 中国台湾
中国台湾 中国
中国 中国香港
中国香港 欧盟
欧盟 印度尼西亚
印度尼西亚 马来西亚
马来西亚 新加坡
新加坡 菲律宾
菲律宾 美国
美国 加拿大
加拿大 印度
印度 越南
越南 泰国
泰国 沙特阿拉伯
沙特阿拉伯